[온열치료전문가 칼럼10] 온열치료의 작용기전: 전신 온열 요법과 면역_2부
지난 주 전신온열요법과 면역에 대한 1부 칼럼을 이어 간다.
우선, 암 치료에 있어서 발열 범위의 전신온열요법(Fever-range WBH)에는 2가지 중첩되는 메커니즘이 있다. 바로 혈류의 변화와 면역학적 변화이다. 열에 의한 면역학적 변화는 다음의 [그림1]과 같이 도식화할 수 있다.
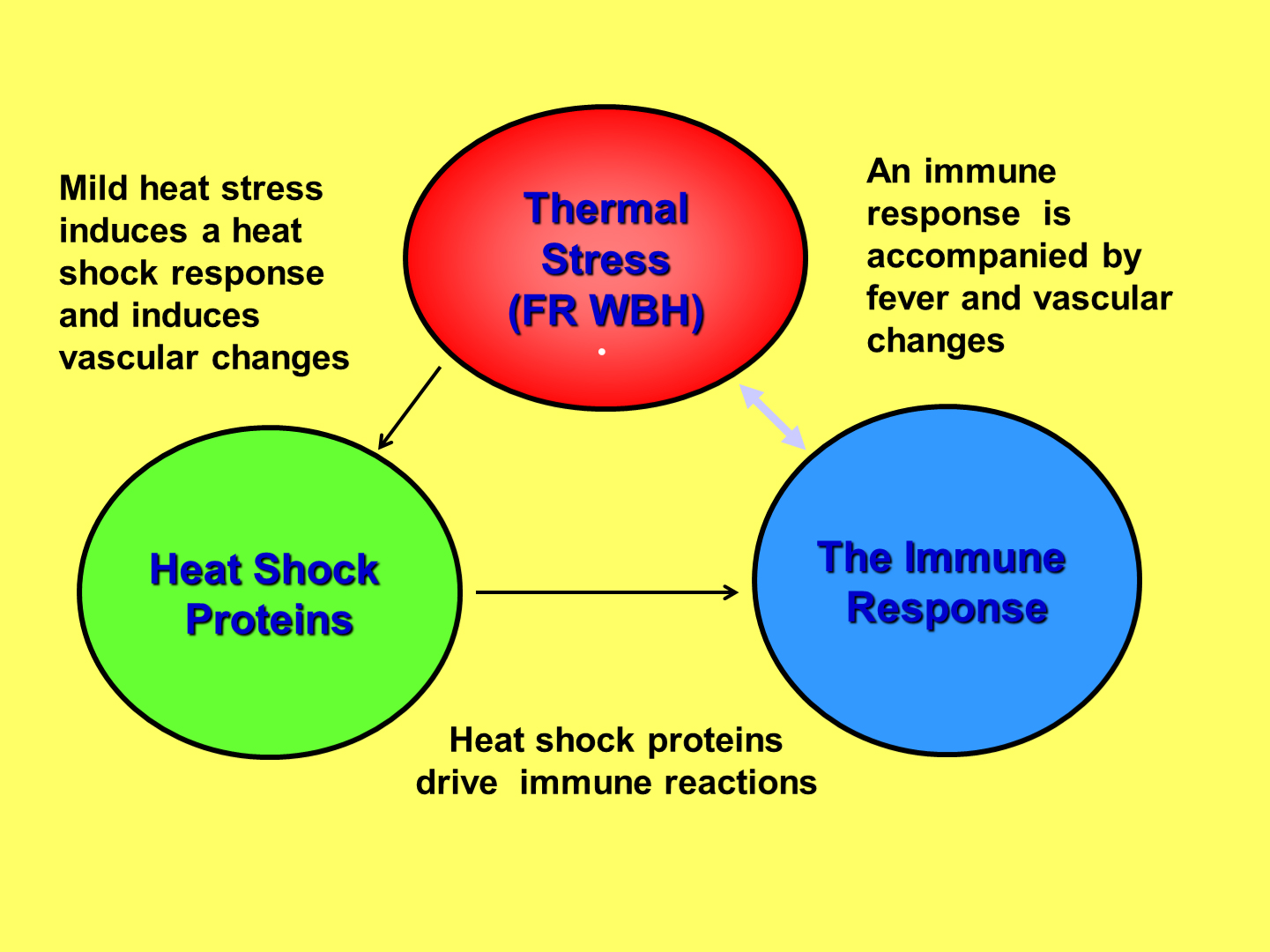
세포는 외부로부터 스트레스를 받으면 스스로를 보호하기 위한 방어기전을 가지고 있는데, 이는 열 충격 단백질(Heat Shock Protein)(주석1)에 의해 매개된다.
HSP는 스트레스에 의해 손상된 단백질을 처리하여 세포 내 항상성을 유지하는 중요한 세포 기능을 수행하는 스트레스 유발 단백질 계열이며 일반적으로 분자량에 따라 지정된다. 분자의 크기(Kilo Dalton)에 따라 HSP100, HSP90, HSP70, sHSP60, sHSP40 등으로 인체의 모든 조직에서 생성되며 지금까지 발견된 HSP는 매우 다양하다.
이 중 가장 대표적인 HSP70은 1962년에 이탈리아 Ritossa교수(주석 2)에 의해 Drosophila(주석 3) 제제에 열 스트레스를 우연히 가한 결과로 발견되었으며, 1980년 중반 단백질 접힘(Protein Folding)을 조절하는 샤페론(Chaperone) (주석4) 기능이 밝혀지면서 HSP에 대한 다양한 연구가 활발해졌다.
이에 따라, HSP 생성을 유도하는 동물실험을 먼저 살펴볼 필요가 있다.
Yueh-Tsu King. et. al.(2002)의 연구에 따르면, 전신온열요법(WBH)에 의한 열 내성의 분자 메커니즘을 알아보기 위하여 전처리 된 생쥐를 통한 HSP70의 유도와 항산화 효소의 활성도를 평가했는데, 쥐의 간에서 HSP70은 30분간 41℃의 WBH에 의해 유도되었을 때, 대조군 대비 3.6배(P<0.0001) 증가한 것으로 나타났다.
30분 동안 WBH를 실시한 후, 48시간의 회복 시간을 가진 경우 생존율은 88.2%로 대조군(37.5%; P<0.01)에 비해 유의하게 높았다. 또한, 15분간 전처리를 실시한 동물의 생존율은 72.2%로 대조군대비 유의하게 높은 수치를 보였다(P<0.05).
WBH의 기여도를 평가하기 위한 효소변화를 살펴보자면, 슈퍼옥사이드 디스뮤타제(주석5), 카탈라제(주석6), 글루타치온 퍼옥시다제(주석7) 등 대표적인 항산화 효소 및 간(肝) 항산화 효소의 활성은 크게 변하지 않았다. 즉, 이 동물 실험을 통한 WBH의 분자 메커니즘의 연구에서는 항산화 효소의 활성보다는 HSP70이 극심한 열 스트레스 속에서 동물의 생존을 돕는 역할을 한다는 점을 제시하였다.
Drosophila에 대한 최근 연구 (Teresa Jagla et. al.,2018)에서 테스트한 95개의 HSP 중 42개의 HSP유전자가 초파리의 발달에 필수적인 역할을 나타낸다는 것이 밝혀졌다.
열 충격 단백질은 세포 스트레스 요인의 영향을 약화시키고 스트레스 반응 동안 세포 내 단백질의 잘못된 접힘과 응집을 방지해 단백질의 샤프론 기능을 수행한다. 현재에 이르러 HSP는 세포 단백질 활동, 회전율 및 이송의 핵심 조절자로서 생리학적으로 다양한 세포 기능의 중심 중재자로 인식된다.
항상성을 유지하는 동안 HSP는적절한 번역(mRNA의 정보를 바탕으로 단백질을 합성하는 과정) 후 단백질 접힘을 보장하고 변성된 단백질을 다시 접거나 비가역적으로 손상된 단백질을 파괴하도록 PTM(Post-Translational Modification)(주석 8)에 의해 HSP를 조절한다. 중요한 세포 활동을 고려할 때 HSPs는 스트레스를 받지 않은 세포에서 가장 풍부한 단백질 유형 중 하나로써 전체 세포질 단백질의 1~2%를 차지한다.
암세포에서 HSPs는 이미 언급한 바와 같이 단백질의 균형을 맞추고 다양한 스트레스 조건으로부터 세포를 보호하는 분자 샤페론으로서 큰 계열을 차지하지만, HSPs는 그 발달 과정에서도 적극적인 역할을 한다는 근거들이 늘어나고 있다.
특히, HSP70 발현을 통해 항암약물과 같은 스트레스 조건 아래에서도 암세포가 살아남는 기전이 알려지며 종양학 분야에서 그 연구가 활발하게 이루어지고 있고, 알츠하이머 등 여러 중증질환 및 자가 면역계 질환에서도 HSP에 대한 연구가 다양하게 전개되고 있다.
HSP는 다양한 종양 유형에서 존재하며 여러 가지 생존에 이점을 제공하는 기능을 갖는데, 형질 전환된 종양 세포에서 HSP의 활동은 복잡하고 다양하다. 인간 췌장암, 전립선암 및 위암 세포에서 입증된 것처럼 특정 HSP인 HSP70이 암세포의 세포 사멸 경로를 직접적으로 억제한다는 증거가 있다.
HSPs는 또한 열 내성(Thermotolerance)이라고 불리는 과정에서 잠재적으로 세포 독성이 있는 고열에 대한 저항성을 매개하는 것과 관련되어 있다.
보다 구체적으로, 고열에 노출된 종양 세포에서 HSPs의 합성 및 축적은 HSPs가 중요한 세포 단백질을 구조하거나 복원할 수 있기 때문에 추가적인 열 관련 세포 독성이 일어나는 것으로부터 보호할 수 있다.
열 내성은 연속되는 고열 변화에 반응하지 않는 종양 세포 집단을 생성하는 능력이 있으며 이는, HSPs는 세포의 생존에 영향을 미칠 뿐만 아니라 혈관 신생, 침입, 전이 및 불멸화 메커니즘에 참여함으로써 암세포의 악성 표현형을 지원한다는 증거가 있다.
따라서, HSP 발현이 종양 세포에 여러 이점을 주는 반면, HSP의 종양 세포 의존성은 가상의 아킬레스건과 같아 HSP가 잠재적이고 매력적인 암 치료 목표가 될 수 있음을 시사한다.
면역 체계는 '위험 신호'(주석 9)로 작용하는 HSPs의 능력을 활용하여 증폭된 면역 반응을 생성할 수 있도록 진화했다. 스트레스를 받거나 죽어가는 세포에서 방출된 HSP는 수지상 세포(DC)를 활성화하여 성숙한 APC(주석 10)로 변환한다.
DC에 의한 HSP의 세포 내 이입은 여러 보조 자극 분자 외에도 MHC 클래스 II 분자의 세포 표면 발현을 증가시켜 항원의 면역인식을 강화한다.
성숙한 DC는 항원 제한 방식으로 림프구 이펙터 세포(주석 11)를 프로그래밍할 수 있으므로 표적 항원을 발현하지 않는 정상적인 건강한 조직의 부수적 손상을 제한할 수 있다.
세포 내 이입 및 DC에 의한 처리 이전에 단백질을 보호하는 HSPs의 능력은, 잠재적으로 제시된 에피토프(주석 12)의 레퍼토리(repertoires)와 면역 반응의 스펙트럼을 넓힐 수 있다. 이 과정에서, 모든 종양세포에 존재하는 상당수의 돌연변이 면역체계가 이물질로 인식할 수 있는 고유한 항원과 에피토프를 가진 단백질 생성물을 만들어내는데, 종양 세포가 표적 면역 반응에 대한 항원 역할을 할 수 있는 독특한 단백질을 발현시키는 것이다.
이론적으로 발열 범위의 전신온열요법(Fever-range WBH)은 종양 세포로부터의 HSP 방출을 유도하고 종양 항원에 대한 DC 감작(Priming)을 증가시킴으로써 종양세포의 항원 표시를 강화하고 종양 세포에 풍부하게 발현된 HSPs를 활용함으로써 전신 면역 생성을 유발하며 HSP 기반 백신 전략을 상승시킬 수 있음을 시사한다.
종양 세포에서 HSPs의 방출은 정지 APC의 강력한 활성화 신호 역할을 할 수 있다. 방출된 종양 세포의 HSP의 함량에 따라 DC 성숙을 유도하는 능력은 높이고, 주로 괴사성 종양 세포에서 생성되는 HSP는 세포 사멸 종양 세포에 비해 항원 교차 제시를 더 효율적으로 증가시킨다는 연구들이 있다. 이는 고열은 사용된 온도와 노출 시간에 따라 종양 세포 괴사 또는 세포 사멸의 중재자 역할을 할 수 있기 때문으로 보인다.
선천적 항 종양 면역의 중요한 매개체로서 NK 세포는 고열에 반응하는 것으로 알려졌으며, 임상 시험 시, 발열 범위의 전신 온열요법(Fever range WBH)에 노출되면 여러 암 유형에 대한 내인성 NK세포의 세포 독성이 개선된 것으로 나타났다. 아울러, 신체 전반에 걸친 NK 세포의 분포는 전신 온열요법(WBH)에 의해 달라질 수 있으며, 말초 혈액 샘플을 통하여 관찰된 NK 세포의 수치 증가는 면역감시 가능성 향상을 시사한다.
종합적으로, 전신온열요법(WBH) 시행 후 DC 및 NK 세포의 활성화 및 기능 활성화에 대한 증거는 종양학 환경에서 이러한 세포 유형에 대한 온열요법의 효과의 추가 임상 연구를 정당화한다.
또한, 발열 범위의 전신온열요법(Fever range WBH)은 백혈구 수송과 관련하여 특정 혈관 내피 부위에서 접착 분자 발현을 조절하는 것으로 입증되었다. 이는 고열에 노출된 후 종양 미세환경에서 내인성 호중구 및 림프구의 축적이 증가한다는 사실에 의해 입증되었다. 보다 구체적으로, 염증 모델에서 발열 범위의 전신온열요법(Fever range WBH)은 감염 부위뿐만 아니라 종양 부위에서도 호중구 축적을 생성하는 것으로 밝혀졌다.
발열 범위의 전신온열요법(Fever range WBH)에 의해 고열에 노출된 종양 부위에서 HSP 펩타이드 방출과 케모카인 생성 간에 시너지 효과는 면역 반응을 증폭시키는 역할에 해당한다.
발열 범위의 전신온열요법(Fever range WBH)은 림프 조직을 통해 림프구를 순환하여 림프절로 DC 이동을 증가시켜 림프구를 자극함으로써 면역 감시를 개선하고 암 면역 생성에 필수적이며 이러한 일련의 결과들로 항종양 효과를 증폭시킬 수 있다.
림프 조직으로의 림프구 이동과 DC에 의한 프로그래밍 및 종양 부위로의 화학 유인에 대한 새로운 주안점은 [그림 2]에 요약된 바와 같이, 발열 범위의 전신온열요법(Fever range WBH)의 다발성 효과에 의해 뒷받침될 수 있다.
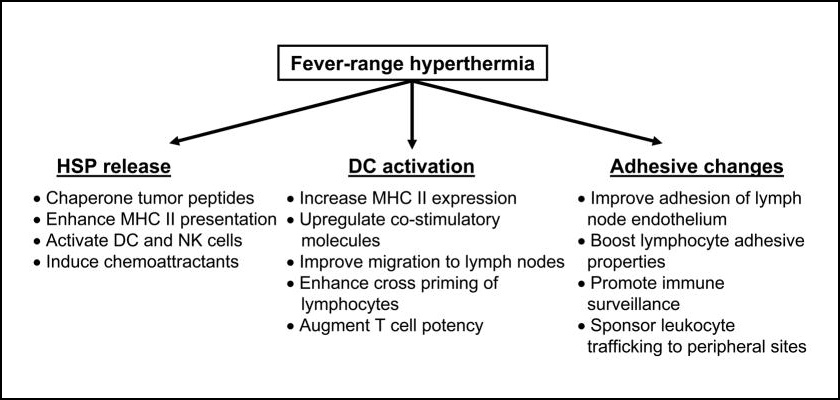
[그림 2]에서 발열 범위의 전신온열요법(Fever range WBH)은 HSP방출을 통해 종양 펩타이드의 샤페론 기능과 MHC II 발현 강화, DC 및 NK 세포 활성화 및 화학 유인물질을 유도하는 효과뿐 아니라, DC 활성화를 통한 MHC II 발현 증가, 공동 자극 분자의 상향 조절, 림프절로의 이동 개선, 림프구의 교차 프라이밍 강화 및 T 세포의 효능을 증가시킨다.
또 접착 변화 측면에서, 림프절 내피 접착 개선, 림프구 접착 특성 강화, 면역 감시 촉진, 백혈구 주변 부위로의 이송을 촉진하는 등의 다양한 효과를 기대할 수 있다.
이로써 기존 면역 요법에 더하여 발열 범위의 전신온열요법(Fever range WBH)을 사용하는 것은 암 치료를 위한 프로토콜로써 독성 없이 재활성화 할 수 있는 효과적인 치료 방식이라 할 수 있으며, 고열의 메커니즘과 면역 체계의 반응은 전도유망한 암 치료에 있어 초석이 되고 있다고 할 수 있다.
각주:
1. 열충격단백질(HSP: Heat Shock Protein): 세포가 외부 자극등에 의한 열 스트레스를 통하여 발현되는 단백질의 일종으로 온열요법에서 매우 중요한 기능을 가진다.
2. Ferruccio Ritossa: 이탈리아 볼로냐대학교 유전학, 분자생물학 교수, 초파리 실험을 통한 열충격단백질(HSP) 최초 발견
3. Drosophila: 초파리(Fruit Flies)는 파리의 한 종류로 주로 단맛이 강한 너무 익거나 썩은 과일에 머무르는 특성이 있다.
4. Chaperone: 다른 단백질들의 입체구조를 돕고 안정화시키는 단백질로, 단백질의 접힘(Folding), 펴짐(Unfolding), 조립(Assembly) 및 해체(Disassembly)등을 수행한다.
5. 수퍼옥사이드 디스뮤타제(SOD; Superoxide Dismutase) SOD는 인체의 산화물질인 자유기(프리 라디칼) 수퍼옥사이드의 라디칼(O2-)을 산소와 과산화수소로 전환시키는 반응을 촉매하는 세포내 주요 항산화제이다.
6. 카탈라제(Catalase) 모든 생명체에 존재하는 항산화 효소로 과산화수소를 물과 산소로 촉매한다. 그러나, 에너지 생성과정에서 그 부산물인 활성산소종(ROS: Reactive Oxygen Species)은 세포를 손상시킨다.
7. 글루타치온 퍼옥시다제 또는 글루타치온 페록시다제(GPX: Glutathion peroxidase) 라고 하며 카탈라제와 같이 과산화수소를 물과 산소로 분해하는 효소이다. 또한, 과산화지질을 분해하여 해독시키는 글루타치온(GSH)이라는 물질의 활동을 촉진하는 효소다. 참고로, 글루타치온 리덕타제(Glutathion Reductase)는 글루타치온(GSH)과 글루타치온 퍼옥시다제(GPX)가 반응하여 활성산소를 중화시키고 최종 산물로서 GSSG(Glutathione disulfide)를 만든다. GSSG는 리덕타제에 의해 GSH로 다시 환원되며 GPX를 통해 프리라디칼(자유기)이라는 활성산소로부터 세포를 보호하도록 한다.
8. PTM: Post-Translational Modification은 단백질이 인산화, 아세트 화 및 메틸화 등으로 생합성 후 거치는 여러 생화학적 변형 과정을 통칭하여 이른다.
9. 위험신호(Danger Signal): HSP의 이중 특성을 나타낸다. HSP의 발현 시 세포 내(Intracellular) 에서는 열내성의 특성을 가지며, 동시에 세포 외부(Extracellular)에서 면역이 활성화 하는, 즉 “위험신호”의 특성을 동시에 갖는다.
10. APC: Antigen Presenting Cell(항원제시세포), APC는 선천면역계의 과립구(Granulocyte) 및 림프구(Lymphocyte)가 작용하는 적응면역계를 이어주는 세포들로서 당, 지질, 내인성 단백질과 결합하는 화학물질등의 항원 또는 항원과 결합하는 IgG와 같은 항체를 붙잡아 소화시키거나 MHC II(주조직 적합성 복합체: Major Histocompatibility Complex II)를 통해 보조 T세포에 전달하는 기능을 수행한다. 대표적인 APC에 대한 기능으로는 단핵구(Monocytes), 대식세포(Macrophage), 수지상세포(Dendritic Cell) 및 B세포가 담당하며 DC의 항원전달능력이 가장 뛰어나다.
11. Lymphocyte Effector Cell: 효과기세포로는 크게 항체를 분비하는 체액성 B세포(체액성 면역담당:Humoral Immunity)와 세포성 T세포(세포성 면역담당:Cellular Immunity)가 있다. 림프구 효과기세포 또는 림프구 작동세포라 한다.
12. Epitope: 항원결정기(antigenic determinant)는 항체, B세포, T세포, T세포수용체 주조직 복합체(TCR-MHC)의 결합에서 면역계가 항원을 식별하게 해 주는 항원의 특정한 부분이다.
References:
Skitzki et al., Hyperthermia as an immunotherapy strategy for cancer, Curr Opin Investig Drugs. 2009 June ; 10(6): 550–558.
Teresa Jagla et. al., Developmental Expression and Functions of Small Heat Shock Protein in Drosophila, Int J Mol Sci. 2018 Nov; 19(11):3441
Yueh-Tsu King. et. al. Whole-body hyperthermia-induced thermotolerance is associated with the induction of Heat Shock Protein 70 in mice, The Journal of Experimental Biology 205, 273–278 (2002)
Antonio De Maio, Ferruccio Ritossa’s scientific legacy 50 years after his discovery of the heat shock response: a new view of biology, a new society, and a new journal, Elsevier Cell Stress and Charperones, 2012
Gian Franco Baronzio, E. Dieter Hager., Effects of Local and Whole Body Hyperthermia on Immunity, Chapter20, Hyperthermia in Cancer Treatment: A Primer, Medical Intelligent Unit., Landes Bioscience and Springer(2006)
Adrienne J. Peer. E. A. Repasky, Diverse immune mechanisms may contribute to the survival benefit seen in cancer patients receiving hyperthermia, Immunol Res(2009)
본 내용은 의학전문 매거진 메디포스트에서 매주 금요일에 연재됩니다.
출처: http://mdpost.co.kr/View.aspx?No=3291462
'온열치료' 카테고리의 다른 글
| [온열치료 전문가 칼럼12] 온열치료의 작용기전: 전신온열요법과 면역(4편) (2) | 2024.07.24 |
|---|---|
| [온열치료 전문가 칼럼 11] 온열치료의 작용기전: 전신 온열 요법과 면역_3부 (2) | 2024.07.17 |
| [온열치료 전문가 칼럼 09] 온열치료의 작용기전: 전신 온열 요법과 면역_ 1부 (1) | 2024.07.05 |
| [온열치료 전문가 칼럼 08] 온열치료의 핵심, 열량(Thermal dose)과 온도 검증_3편 (0) | 2024.06.27 |
| [온열치료 전문가 칼럼07] 온열치료의 핵심, 열량(Thermal dose)과 온도 검증_2편 (0) | 2024.06.20 |




댓글