[온열치료전문가 칼럼11] 온열치료의 작용기전: 전신 온열 요법과 면역_3부
이번 칼럼은 온열치료의 작용기전 중 전신온열요법과 면역에 대한 세 번째 편으로 체온의 항상성 메커니즘을 먼저 이해하고 전신온열요법중 경〮중도의 온열요법(Mild and Fever range WBH)에 의한 심부 온도 상승을 통하여 종양 미세환경에서 저산소증(Hypoxia)(각주1)에 의한 면역억제에 관해 쓰고자 한다.
체온 조절은 열 생성과 열 손실의 균형을 맞춰 생리학적 핵심 체온을 유지하는 것이다. 지난 칼럼에서 건강한 사람의 심부 체온은 37℃ ±0.5℃임을 언급했으며, 이는 신체의 대사 과정이 올바르게 기능하는 데 필수적인 온도 범위이다.
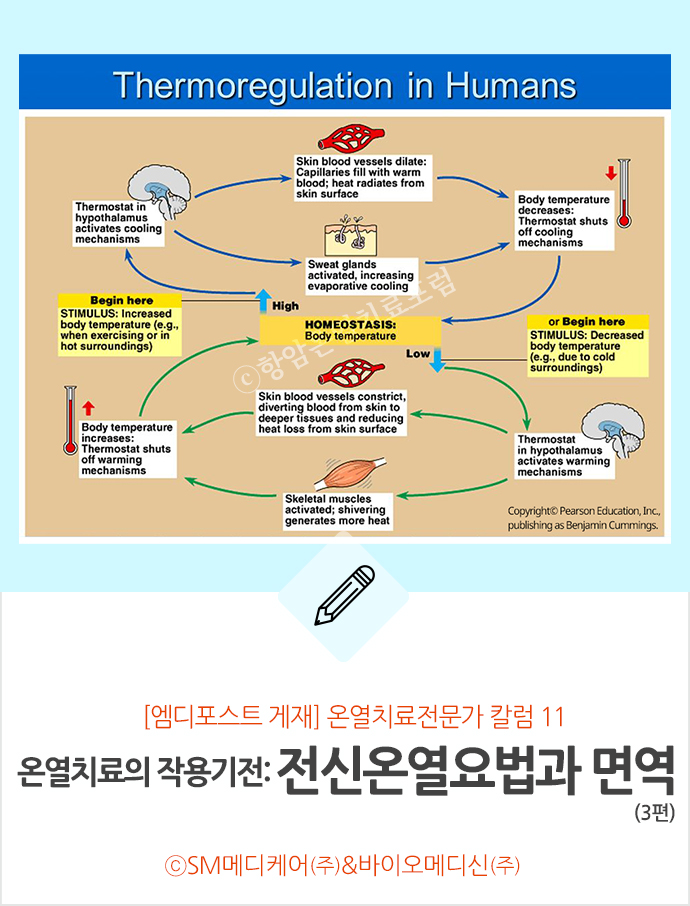
인체의 온도 조절 장치는 시상하부 온도 조절 센터(Hypothalamic thermoregulatory center)로, 보다 구체적으로는 시상하부 시신경 전 영역에 위치하고 있다. 이 센터는 인체 전체의 기준점을 설정하고 온도 항상성(Homeostasis)을 조절한다. [그림1 참조]
시상하부에는 온도 수용체(Thermoreceptor)라고 불리는 신경 세포를 통해 정보를 받는 온도 센서가 포함되어 있으며 신체에는 말초 부위 및 중앙 온도 수용체가 있다. 말초 온도 수용체는 피부에 자리 잡고 있어 표면 온도를 감지하고, 중앙 온도 수용체는 내장, 척수, 시상하부에 위치하며 심부 온도를 감지하는 역할을 수행한다. 체온의 변화는 시상하부의 시각 전 영역에 정보를 제공하는 온도 수용체를 활성화한 뒤, 이 영역은 체온 조절 메커니즘을 활성화하여 체온을 높이거나 낮추고 기준점으로 되돌린다.
체온 조절 메커니즘에는 몸의 말초 신경계에서 중앙으로 들어오는 구심성 신경(afferent nerve) 감지, 중앙 제어 및 뇌에서 발생한 반응을, 말초신경을 통해 신체 기관으로 전달하는 원심성 신경(efferent nerve)반응이 포함된다.
말초 및 중앙 온도 수용체는 체온의 증가 또는 감소를 감지해 이 정보를 시상하부로 보내고, 이 정보를 가지고 신체는 신체의 필요에 따라 열을 방출하거나 생성하는 여러 메커니즘으로 반응한다. 온도 수용체의 활성화에 대한 생리적, 행동적 반응은 다음과 같다.
신체는 상승한 체온을 다음과 같이 반응함으로써 열을 발산한다;
• 땀샘에 분포된 교감 신경성 콜린성 섬유를 활성화하여 땀 배출이 증가하거나 열 손실이 증가하기도 한다.
• 피부 혈관의 교감신경 활동을 억제함으로써 혈액이 피부로 이동하고 열 손실이 증가하게 된다.
• 부신속질(부신수질)에서 카테콜아민(각주2)을 분비하고 시상하부에서 갑상샘 호르몬의 방출을 감소시켜 대사율을 감소시킨다.
• 행동 변화로는 움직임 둔화, 몸을 벌린 자세 유지, 옷 벗기 및 식욕 부진 등이 나타난다.
또한, 신체는 체온 감소를 다음과 같이 반응함으로써 열을 생성한다;
• 교감신경계를 활성화하여 피부 세동맥의 혈관 수축을 유발하고 혈액이 피부를 우회하게 함으로써 열 손실을 감소시킨다. 또한 부신속질(부신수질)은 카테콜아민(에피네프린, 노르에피네프린) (각주 2)을 방출하여 대사율과 열 생산을 증가시킨다. 이때, 입모(소름이 돋는 현상)(각주3)도 발생하며 열이 갇히게 된다.
• 시상하부에서 갑상샘 호르몬을 방출하면 대사율이 증가하고 그에 따른 열 생산이 증가한다.
• 후방 시상하부의 일차 운동 센터를 활성화하면 골격근 수축과 떨림이 발생하여 열 생산이 증가한다.
• 생후 첫 6개월 동안은 갈색 지방 조직(BAT; brown adipose tissue)을 사용해 떨림 없는 열 발생이 이뤄진다.
• 행동 변화에는 움직임 증가, 몸을 닫은 자세(웅크림) 유지, 옷 입기, 식욕 증진 등이 포함된다.
지금까지 인체의 온도 항상성 메커니즘의 이해를 돕고자 설명하였다. 이제 암 치료에 있어서 경도 및 중도의 전신 온열요법(Mild and Fever range WBH)을 사용해야 하는 새로운 이유를 저산소증(Hypoxia)을 통하여 알아보고자 한다.
종양 미세환경 내의 저산소증은, 방사선 및 화학요법 후 불량한 치료 결과 및 암 환자의 전체 생존율 감소와 상관관계가 있다는 근거는 차고 넘친다. 저산소증이 종양 성장을 지원하고 효과적인 방사선 및 화학요법을 방해하는 여러 분자 메커니즘이 현재 잘 확립되어 있다.
반면, 몇 가지 새로운 연구에 밝혀진 종양 미세 환경에서 저산소증의 또 다른 좋지 않은 결과, 즉 항 종양 면역 효과 세포의 억제 및 면역 감시로부터의 종양 탈출 강화를 지적하는 점은 매우 중요한 포인트이다. 저산소증이 여러 가지 유형의 면역 효과 세포를 무력화시키고 면역 억제 세포의 활동을 강화해 면역 세포가 종양 세포의 존재를 "눈뜬장님(맹인)" 이 되도록 돕는 새로운 길을 제공한다는 연구 데이터를 주목하여야 한다.
그러나 경도 및 중도의 전신온열요법(Mild and Fever range WBH)은 이러한 종양 미세 환경 내에서 저산소증에 의해 꽉 조이는 혈관 관류 및 산소 장력을 신속하고 안전하게 풀어주는 생리학적으로 조절자 역할을 수행함으로써 보다 효과적인 면역 기반 치료법의 장벽을 줄일 수 있는 큰 이점이 있다.
최근까지 대부분의 암 치료법을 이끄는 기본 근거는, 암 치료 시 종양 세포의 민감도가, 종양 세포 자체의 본질적인 특성을 발생시키고 이러한 특성은 미세 환경과 무관하게 발현된다는 것이었다. 종양 내 암세포는 그 생성 과정에서 스스로 잠재적 취약 특성(종양 세포의 유사분열 지수 증가)을 일으키는데, 대다수의 화학요법 약물의 효능은 이를 이용해 치료하도록 설계되어 있다.
마찬가지로 대부분의 면역요법 연구의 경우, 종양 세포의 고유한 면역원성(또는 면역원성 부족)에 중점을 두었다. 이에 따라 환자에게 종양항원을 접종하여 약한 종양 인식을 강화하려는 노력이 많이 이루어지고 있다.
온열요법 분야에서도 종양 부위에 과도한 열을 전달하려는 근거 중 하나는, 열 충격의 능력에 초점을 맞춰 개별 종양 세포 내 DNA 복구 경로의 열 조절을 통해 방사선 손상을 강화할 수 있는 온도 전달이 핵심이다. 이 근거에 따라, 온열 암 치료 프로토콜은 이러한 내인성 방사선 강화 메커니즘을 이용하기 위해 종양 내부가 충분한 열을 얻는 것을 치료 목표로 한다.
그러나 현재 연구에 따르면 화학요법, 방사선요법, 면역요법, 심지어 온열요법에 대한 고형 종양의 반응은 단지 종양 세포의 고유한 분자 특성이나 면역 세포에 의해 인식되고 사멸되는 측면만 볼 수 없다.
이제 다양한 치료법에 대한 개별 종양 세포의 반응을 조절하고 종양 세포의 고유 표현형을 변경하는 데 있어서 종양 미세환경과 종양을 둘러싸고 침윤하는 정상 세포의 역할에 대한 인식이 상승되는 점에 초점을 맞춰야 한다.
화학요법 시 종양의 반응에 영향을 미치는 중요한 요인은, 종양 세포의 대사 환경과 종양 미세환경에 대한 약물의 기본적인 혈관 접근이다. 정상 조직에서 나타나는 항상성 조절 결여와 결함을 가진 혈관 채널의 결합은 약물 흡수를 감소시킬 뿐만 아니라 종양 내 저산소 영역 형성에 기여한다. 이러한 특성은 종양의 성장과 충분한 혈관 형성을 유도하는 능력을 촉진하는 것으로 알려져 있다.
마찬가지로 방사선 치료의 경우, 미세환경의 산소 부족은 방사선으로 인한 최대 DNA 손상을 방지하는 중요한 요소이며, 반대로 미세환경의 충분한 산소는 방사선 치료를 극대화할 수 있는 민감제(Sensitizer)가 된다.
면역요법의 경우, 염증의 정도와 종양 내 특정 사이토카인 및 케모카인의 농도가 종양 세포의 면역원성과 면역 세포 활성화 잠재력을 크게 변화시킬 수 있다는 사실에 대한 인식이 훨씬 더 커졌다.
최근 연구들은 항종양 면역체계의 효능이 종양 미세환경의 저산소증 정도에 따라 크게 달라질 수 있음을 시사했다. 저산소증은 화학 요법과 방사선의 효과를 둔화시킬 뿐만 아니라 자연 숙주 항종양 면역 세포의 효능을 억제하고 면역 감시를 회피하는 종양의 능력을 향상시키는 환경에 기여할 수도 있다는 점과, 자연적으로 발생하는 체온 조절 항상성 과정을 활성화하는 능력을 통해 온열요법(특히, 경·중도의 전신온열요법)을 사용하는 이유와 더불어 종양의 혈관 관류를 조절하고 저산소증 영역을 감소시킬 수 있는 몇 가지 이유를 강조했다.
면역 세포 활동을 자극하는 능력은 암의 자연적인 면역 반응을 향상시킬 수 있다. 연구자들은 저산소증으로 인한 종양 면역억제의 역전이, 적어도 여러 가지 국소적 발생 종양(흑색종, 식도암, 국소적으로 진행된 두경부암, 국소적으로 진행된 자궁경부암 및 신경교종 등)에 대한 제 Ⅱ상 임상 연구 및 제 Ⅲ상 임상 연구에 따르면, 다른 암 치료법과 온열요법을 병용한 후 나타나는 긍정적인 생존 혜택과 국소 종양 재발 감소를 설명하는 데 도움이 될 수 있다고 보고했다.
또 다른 제 Ⅲ상 임상 연구에서 단독 방사선 요법에 비해, 방사선 요법과 온열요법을 병용할 때 유방암의 흉벽 재발에 대한 탁월한 국소 제어 및 지속성 반응에 기여한다고 전하였다. 이러한 성공은 온도가 암 치료의 효능에 영향을 미치는 잠재적인 메커니즘을 이해하는 데 대한 관심을 다시 불러일으키고 있다. (4부에서 계속)
각주
1. 저산소증(Hypoxia): 인체 전반 또는 특정부위의 산소가 부족한 현상으로 체내 산소 분압 및 산소포화도가 기준치 이하로 떨어져 세포 기능에 영향을 미치게 된다. 저산소증은 호흡기, 순환기, 빈혈 및 대사성 질병과 연관되어 있으며 다른 화합물과 결합할 경우 이차성 질환을 초래한다. 또한, 저산소증은 종양미세환경에서 면역기능을 억제하고 암치료의 제약 요건으로 작용한다.
2. 카테콜아민(Catecholamine)은 카테콜(catechol)에서 유래된 모노아민 계열 신경전달물질 또는 호르몬을 총칭하며 부신수질에서 분비되며 에피네프린(epinephrine), 노르에피네프린(norepinephrine), 도파민(dopamine) 등이 카테콜아민류에 포함된다. 카테콜아민은 교감신경이 지배하는 장기에 작용하여 혈압을 상승시키고, 간에서 글리코겐 분해를 촉진시켜 혈당을 상승시키는 등의 역할을 한다. 에피네프린(epinephrine)은 아드레날린이라고도 하며 호르몬 및 신경전달물질로써 여러 응급상황에서 매우 유용한 약물로 사용되며 교감신경계를 활성화하여 우리 몸이 갑작스런 자극 및 응급상황에 반응하기 위한 에너지를 낼 수 있도록 돕는다. 노르에피네프린(norepinephrine)은 기본적으로 교감신경계를 자극하므로 이것이 분비되면 집중력 증가, 혈류량 증가, 대사활동 증가 등의 효과가 있다.
3. 입모(立毛, piloerection): 우리가 춥거나, 흥분하거나, 충격을 받거나, 아니면 겁을 먹을 때 생기는 모낭의 주름을 말하며, 교감 신경의 흥분 따위에 의하여 모근이 수축하여 털이 곤두서는 현상 임.
References:
Eva V. Osilla. et. al., Physiology, Temperature Regulation, Copyright© 2024, StatPearls Publishing LLC.
Dewhirst MW, Cao Y, Moeller B. Cycling hypoxia and free radicals regulate angiogenesis and radiotherapy response. Nat Rev Cancer 2008;8(6):425–37.
Vaupel P. Hypoxia and aggressive tumor phenotype: implications for therapy and prognosis.,Oncologist 2008;13(Suppl 3):21–6.
Kudo T, Ueda M, Kuge Y, Mukai T, Tanaka S, Masutani M, et al. Imaging of HIF-1-active tumor hypoxia using a protein effectively delivered to and specifically stabilized in HIF-1-active tumor cells. J Nucl Med 2009;50(6):942–9.
Vaupel, PW.; Hockel, M. Oxygenation status of human tumors: a reappraisal using computerized pO2 histography. In: Vaupel, PW.; Kelleher, DK.; Gunderoth, M., editors. Tumor oxygenation. Fischer; Stuttgart: 1995. p. 219-232.
Minn H, Gronroos TJ, Komar G, Eskola O, Lehtio K, Tuomela J, et al. Imaging of tumor hypoxia to predict treatment sensitivity. Curr Pharm Des 2008;14(28):2932–42.
Vaupel P, Mayer A. Hypoxia in cancer: significance and impact on clinical outcome. Cancer Metastasis Rev 2007;26(2):225–39.
Vaupel P, Thews O, Hoeckel M. Treatment resistance of solid tumors: role of hypoxia and anemia. Med Oncol 2001;18(4):243–59.
Lundgren K, Holm C, Landberg G. Hypoxia and breast cancer: prognostic and therapeutic implications. Cell Mol Life Sci 2007;64(24):3233–47.
본 칼럼은 의학전문 매체 엠디포스트에서 매주 금요일 연재됩니다.
http://mdpost.co.kr/View.aspx?No=3297747
'온열치료' 카테고리의 다른 글
| [온열치료 전문가 칼럼13] 온열치료의 적용기술_하이드로선(wIRA), 1편 (0) | 2024.08.02 |
|---|---|
| [온열치료 전문가 칼럼12] 온열치료의 작용기전: 전신온열요법과 면역(4편) (2) | 2024.07.24 |
| [온열치료 전문가 칼럼 10] 온열치료의 작용기전: 전신 온열 요법과 면역_ 2부 (0) | 2024.07.10 |
| [온열치료 전문가 칼럼 09] 온열치료의 작용기전: 전신 온열 요법과 면역_ 1부 (1) | 2024.07.05 |
| [온열치료 전문가 칼럼 08] 온열치료의 핵심, 열량(Thermal dose)과 온도 검증_3편 (0) | 2024.06.27 |




댓글