[온열치료 전문가 칼럼31] 온열치료의 메커니즘과 효과
이번 칼럼은 지난, 11월 10일 백범김구기념관 컨벤션홀에서 개최된, 임상 통합의학 암학회(CSIO)의 제15회 추계 국제 학술 세미나에서 필자가 발표한 주제인 ‘온열치료의 메커니즘과 효과’에 대해 기술하고자 한다.
이번 추계학회는 일본에서 초빙한 연자들의 일본의 통합의학적 암 치료와 독일에서 초청한 독일 온열종양학회장의 유럽의 통합의학적 암 치료 및 국내 연자들의 한국의 통합의학적 암 치료에 대한 최신 지견을 발표한 국제적인 학술 세미나로, 임상에 적용할 수 있는 다양한 기법들에 대하여 200여 명의 청중들의 뜨거운 열의와 증폭된 관심 속에 성황리에 마무리되었다.
오늘은 지난 5월 31일 칼럼 5편 ‘온열치료의 작용기전’의 연장선상에서 ‘온열치료의 메커니즘과 효과’에 대해 최신 임상 연구를 중심으로 다뤄보려 한다.
RF(Radio Frequency), 즉 무선주파수로 유도하는 암 치료에 있어서 온열치료(Oncological Hyperthermia Treatment)는 39℃에서 43℃까지의 심부온도를 달성하는 것을 목표로 하며, 심부온도 43℃에 도달하기 위해서는 258kcal에 달하는 열에너지를 흡수해야 한다. 이러한 43℃라는 심부온도 목표는 종양세포에 돌이킬 수 없는 세포손상을 주려는 의도로, 종양세포는 유도된 열을 세포 밖으로 빼낼 완전한 능력을 갖추고 있지 않기 때문에 이는 임상적으로 선택적 가온의 필요성이 요구되는 이유이다. 좀 더 자세하게 온열치료에 따른 종양 조직의 생리학적 변화를 살펴보자면, 크게 혈관 효과(Vascular effects) 와 세포효과(Cellular effects)로 나눠볼 수 있다.
종양에 열을 가하면 혈류가 증가하게 된다. 이에 따라, 혈관이 확장되고 혈관의 직경(Diameter) 자체가 커지게 된다. 또한, 혈관의 침투성이 용이해지고 ph.수치가 높아지며 산소 또한 증가하는 효과를 가져올 수 있다.
세포 측면에서 보면, 열을 가하게 되면 종양세포의 막(Membrane) 침투성이 용이해지고 막의 압력도 상승하여 전위차에 의해 분극(Polarization)이 발생하고 나트륨(Na) 등 이온들이 종양세포 속으로 쉽게 유입되게 된다. 이때, 종양세포는 열에 의하여 열충격단백질(HSP)을 분비하게 되는데, 이로 인하여 HSP 수용체가 상향 조절된다. 종양세포 내에서는 단백질의 변성이 일어나고, DNA 복구 기전이 심각하게 손상 받게 된다.
또한 온열치료는 대사율을 높여, 활성산소(ROS)의 생성을 더욱 증가하게 한다. 이에 따라 단백질 손상이 나타나 단백질의 산화, 응집 및 변성이 촉진된다. 이는 세포 내 핵단백질에 손상을 일으켜 DNA 복구 기전을 억제하게 된다. 또한 세포증식을 억제하여 세포 성장주기인 G1 phase에서 세포주기가 마침내 정지하게 되며 손상된 DNA 단편들이 쌓이고 이로 인하여 세포에서 유사분열 대재앙이 발생하게 된다. 또한, 막 손상이 일어나 막 경유 단백질 및 이온 수송 기능이 바뀌고, 세포 신호 전달체계가 변경되며 수용체 기능에 변화를 불러와, 결국 세포는 죽게 된다.
결론적으로, 온열치료로 인한 암세포의 열 민감성 반응으로는, 낮은 열량(Low Thermal Dose)에서는 세포 자멸(Apoptosis)이, 높은 열량(High Thermal Dose)에서는 세포가 괴사(Necrosis)가 발생하는 것이다.
RF 전자기장에 의해 유도된 세포막에 전기적 작용은 세포 막전위를 회복시켜 세포 내 세포 외 활동을 재활성화한다. [그림 1]에서 보다시피, 종양세포에는 많은 포도당(Glucose)이 유입되고, 세포 외막(ECM: Extra cellular membrane)에서 이온농도가 높지만, 막 전위는 상대적으로 낮다. 반면, 건강한 세포에는 적은 포도당(Glucose)이 세포 안으로 유입되고, 정상적인 세포막을 유지한다. 또한, 건강한 세포의 막전위(Membrane Potential)는 높게 나타난다. 따라서, RF에 의한 전기장은 마치 방전에 다다른 배터리를 충전시켜 주듯 종양세포의 복원 효과를 가져다주는 셈이다.
지금까지 온열치료로 유도할 수 있는 심부 고온 및 전자기 효과에 대해 알아보았다. 이를 [그림 1]의 오른쪽 그래프와 같이 도식화해 보면, 600와트의 출력을 가진 온열치료 장비라면, 전자기 효과를 기대하기 위해서는 50와트(W)의 출력부터 전자기장을 유도할 수 있다. 여기에 고주파 대역(band)의 주파수에 더하여 세포를 공명시키는 장기별 고유 주파수인 디지털 진폭 변조 주파수가 동시에 유도될 경우, 종양세포의 죽음이 더욱 가속화될 수 있다.

하지만, 진정한 의미의 온열치료를 통한 심부열을 제대로 도달케 하기 위해서는, 250와트(Watt) 이상의 출력이 필요하므로, 출력에 따른 열량(Thermal Dose) 상승 목표는 효과적인 온열치료를 위해 임상적으로 매우 중요한 포인트임을 잊지 말아야 한다.
최근 수십 년간 발표된 온열치료에 관한 연구에 따르면 심부 온도 39~42℃ 사이의 중간 열량을 전달할 수 있는 소위 "경도의 고열(Mild Hyperthermia)"에 집중(Song, 2005) 되었음을 알 수 있다. 이러한 열량 투여의 이점은 39℃에서부터 시작되는 산소 관류가 산소 수치를 올려 방사선 치료의 효과를 증가시키고 더 높아진 관류를 통해 약물 흡수가 종양 속으로의 더 좋아진다는 것이다. 41.5℃에서 시작하는 열량의 이점은 열민감성으로 인하여 DNA 복구 억제(G van Rhoon et al, 2000)에 있다는 것이다.
그렇다면 열은 왜 암을 파괴하는 것일까?
이에 대한 해답은, 듀크 대학교 의료 센터의 마크 드훠스트(Mark Dewhirst) 박사가 보고한 ‘종양을 가열하면 종양 세포의 죽음을 앞당기는 일련의 변화가 일어난다’라고 2010년 미국국립암연구소(NCI)에서 발간한 국제 저널에서 찾을 수 있다. 마크 드훠스트 교수와 로스웰 파크 암센터의 면역학자 엘리자베스 레파스키(Elizabeth Repasky)박사는 2010년 옥스퍼드대학교 출판물에서 종양 미세환경(TME)에서 온열치료의 주요 메커니즘 및 효과에 대해 보고했다. 그 내용으로는, 혈관 누출이 화학요법 중 종양으로의 약물의 전달량(Drug Delivery)을 증가시키며, 산소 수치의 증가는 방사선 치료 중 치료 저항성과 조직 저산소증을 줄여준다. 또한, DNA 복구 억제는 브라카2(BRCA2) 분해를 포함한 상동 재조합 DNA 복구 경로 억제 및 면역체계 자극은 선천적 반응 세포의 증가 및 항원제시세포(APC)에서의 수지상 세포(DC)를 진화시키는 메커니즘을 꼽을 수 있다고 언급했다.
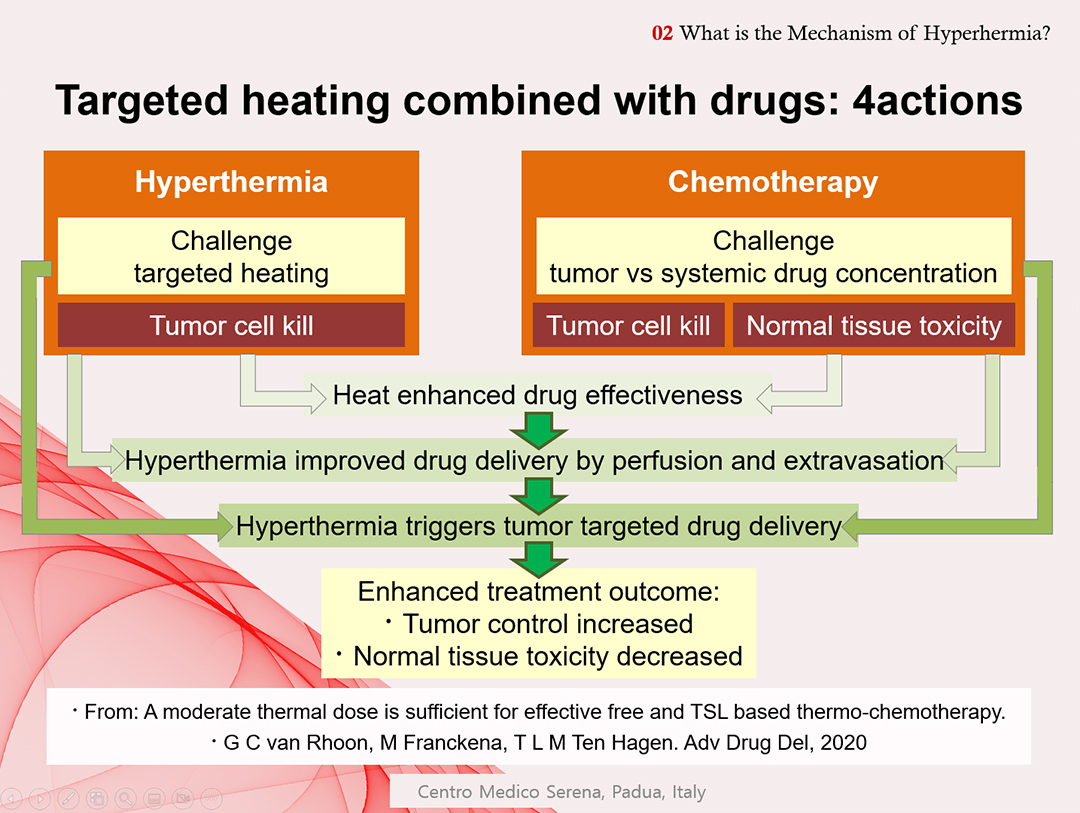
네덜란드 에라스무스 메디컬 센터의 반 룬 교수의 연구(G van Rhoon et al, 2020)에 따르면, 온열치료는 종양에 열을 집중시킴으로써 화학 요법의 효과를 높이고, 관류와 유출에 의한 약물 전달을 개선하고, 열에 민감한 리포좀(Liposomal) 약물 운반체를 사용하여 종양에서 국소 약물 방출을 높이고 증가된 종양의 통제 및 정상조직의 독성을 감소시키는 등 향상된 치료 결과를 가져올 수 있다고 보고했다. [그림 2] 참조
현 유럽 온열종양학회(ESHO) 회장인 크레지(Crezee)박사는 네덜란드 암스테르담 메디칼 센터에서 그의 연구팀이 수행한 국소적으로 진행된 자궁경부암에 대한 포괄적인 연구 결과를 2022년 국제부인 종양 학회지에 기고했는데 그는 고식적인 화학·방사선치료와 온열치료의 병합을 강조했다.

[그림 3]에서 위쪽(A)를 보면, 방사선 및 화학요법은 DNA 이중나선 구조를 끊어 냄으로써 DNA 손상을 유발하고 종양을 죽게 하는 데 있어 DNA 복구기전에 따라 손상된 DNA가 복구되어 재증식할 수 있는데, 여기에 온열치료를 추가해, 온열에 의해 발생한 열 민감성이 방사선 요법 또는 화학 요법에 의한 손상 DNA 복구를 일시적으로 억제하여 종양 세포 사멸을 가속화할 수 있다고 보고했다.
[그림 3]의 아래 위치한(B)에서는, 온열치료가 종양 미세 환경(TME)과 종양 세포 자체에 모두 영향을 미친다는 것을 보여준다. 낮은 온도인 39℃에서 시작한 온열치료는 관류와 재산소화를 증가시켜 종양 미세 환경을 교란시킬 수 있다. 더구나, 온열치료는 면역 세포를 종양 미세 환경으로 끌어들이는 것으로 밝혀졌다. 41°C에 시작한 온열치료는 열 민감성에 의해 일시적으로 DNA 복구 경로를 억제해 DNA 파손이 축적되고 그로 인하여 세포 주기가 중단된다는 것이다. 그 후, DNA 파손을 복구하지 못하면 세포 사멸이 일어난다고 보여주었다.
마지막으로 최근의 연구 보고들에 따르면, 온열치료의 새로운 패러다임은 바로 면역요법을 증강시킨다는 점이다. 2019년 뉴욕 메디컬 센터의 마크 허위츠(Mark Hurwitz)박사의 ‘생체 내 및 시험관 내 연구 보고’에 따르면 세포 외 환경으로 열 충격 단백질(HSP)이 더 많이 방출하게 되면 하류 면역 활동이 자극돼 항원 제시가 증가하여 암 면역 주기 시작이 촉진된다는 점을 전했다. 이미 증명된 흑색종, 방광암, 두경부암을 포함한 여러 다양한 암 종에 관한 임상 연구에서 온열치료는 면역요법을 향상시키는 가장 강력한 잠재력을 가진 향상자(Potential Enhancer)라는 것이다.

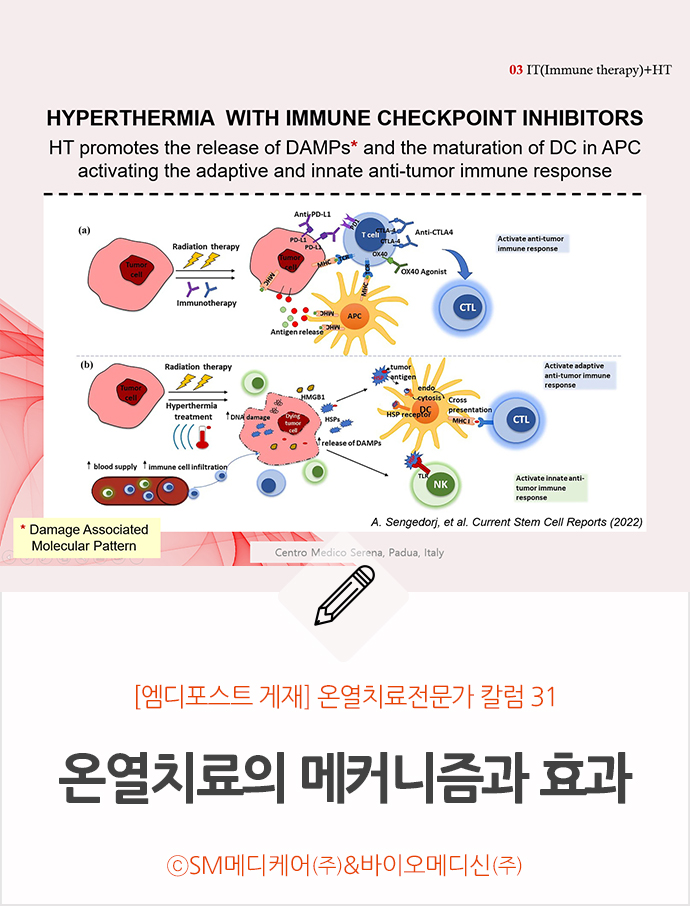
위 [그림 4]는 면역 체크포인트 억제제와 온열치료를 함께 방사선 요법을 시행한 경우 면역 체계에 미치는 영향에 대한 그림이다.
그림 윗줄에 위치한 (a)는 방사선 요법 후 특정 억제 면역 체크포인트 분자(ICM)가 종양 세포에서 상향 조절된다. 이러한 억제면역 체크포인트 분자들을 억제하는 면역 체크 포인트 억제자로는 anti-PD-L1, anti-CTLA-4 등이 있는데, 이러한 억제 면역 체크 포인트 분자들이 T세포 활성화에 미치는 영향을 감소시키고 항종양 면역반응을 더욱 활성화한다. 수지상 세포(DC)가 종양 항원을 주조직 적합성 복합체1(MHC1) 분자와 교차 제시하면 세포독성 T 림프구들(CTL)이 활성화돼 종양 세포를 제거한다는 설명이다.
그림 아래줄에 위치한 (b)는 온열치료가 종양을 방사선요법 시에 더욱 민감하게 만든다는 내용이다. 방사선 치료 시 온열치료에 의한 열 민감성을 통하여 종양 세포 사멸과 DAMP 방출을 증가시켜 방사선 요법의 효과를 높인다. 종양세포에서 방출된 DAMP(HSP, HMGB1, DNA, RNA 단편 및 기타 항원)는 수지상 세포(DC)에 의해 흡수되어 세포독성 T 림프구들(CTL)을 더욱 활성화시켜 적응성 항종양 면역 반응을 활성화한다. 또한, 방출된 열 충격 단백질(HSP)은 선천면역 반응을 유도하는 세포막 수용체 단백질인 톨유사수용체(TLR:Toll - Like Receptor)와 결합하여 자연살상세포(NK cell)를 활성화한다. 온열치료가 종양 혈액 공급과 종양 부위로의 면역 세포 침윤을 증가시키며, 이러한 모든 효과는 선천적 및 적응적 항종양 면역 반응의 활성화로 이어진다는 내용이다.
지금까지 온열치료의 주요 메커니즘과 그 효과에 대해 다시 한번 리뷰(Review)해 보았다. 현재까지 보고된 119건의 온열치료의 메커니즘 [표 1]은 다양하며 온열치료 단독연구, 온열치료와 항암약물 병합 연구 및 온열치료와 천연물질 병합 연구 등 세 가지로 분류할 수 있다. 온열치료의 메커니즘은 활성산소(ROS), 열충격단백질(HSP), DNA 손상, 미토콘드리아 막전위 탈분극(MMP Depolarization), 세포주기 정지, 약동학적 변화, 전사인자, 암억제단백질(p53)을 포함한 사멸 단백질의 조절, 세포 생리학적 변화, 세포 사멸 및 세포 괴사이다. (Yi et al, Antioxidants 2022)

끝으로 온열치료의 미래는 세 가지 주요 측면에서 매우 유망하다고 할 수 있다. 첫째, 면역 체크포인트 억제제와 온열치료의 조합, 둘째 DNA 복구 억제제 또는 HSPs 조절자들과 같은 약물의 개발, 마지막으로 이를 위한 온열치료의 정확한 열량 측정과 보다 진전된 기술이 탑재된 최신 온열치료 장비의 개발 및 임상 적용 여부이다.
온열 암치료 장비 선택의 핵심은 시판 후 임상 평가(Post Marketing Surveillance & Clinical Evaluation Report: PMS & CER) 보고서 보유 여부, 그리고 최신 안전성 정보 보고(Periodic Safety Update Report: PSUR) 및 전향적인 임상연구(Prospective Clinical Study)를 통한 그 결과물의 학술적 출판물과 국제학회에서 장비의 품질 수준이 검증되었는지에 있다. 따라서, 온열치료 장비를 운용하는 병원 및 온열 암치료를 선택하는 환자는 이에 대해 반드시 확인해 보는 것이 효과적인 암 치료에 있어서 매우 중요하다고 필자는 주장한다.

[용어 참조]
DAMP: DAMP(Damage Associated Molecular Pattern)는 손상연관분자유형으로 면역숙주에서 유래된 면역반응을 유발하는 분자 유형으로 PPR(Pattern Recognition Receptor; 분자 인지 수용체)에 의해 인식된다.
HMGB1: HMGB1(High Mobility Group Box 1)는 고이동성 1군 단백질이다. 염증반응 후기에 분비되는 중요한 염증유발인자이다. 종양미세환경에서는 종양성장, 혈관신생, 면역억제, 침습, 전이를 촉진하는 종양촉진단백질이다.
MHC 1: MHC 1(major histocompatibility complex Class 1)는 주요 조직 적합성 복합체 클래스 1
PD-1: PD-1(Programmed Death-Ligand 1)는 프로그램된 세포 사멸 리간드1로 암세포 표면에 있는 단백질이다.
CTL: CTL(Cytotoxic T Lymphocyte)은 세포독성 T 림프구를 말하며, 세포표면에 CD8 단백질을 가지고 있다.
CTLA-4: CTLA-4(Cytotoxic T Lymphocyte associated Antigen 4)는 세포독성 T 림프구 관련 항원 4 단백질로 T세포 활성화시 일과성으로 발현되는 T세포 활성항원의 일종으로 CD28과 유사하다.
TLR: TLR(Toll-Like Receptor)은 톨 유사 수용체로 선천면역 반응을 유도하는 세포막 수용체 단백질로 IL-1 수용체와 유사하다.
OX40: OX40은 T세포 표면에서 발현되며 면역반응에 관여하는 분자로 CD134와 유사, OX40-L은 APC에 존재하는 리간드로 OX40과 결합 시 공동자극인자로서 T세포 활성화 기전에 관여한다.
Reference
M. IJff, J. Crezee, AL Oei, Lukas J A Stalpers, H. Westerveld., The role of hyperthermia in the treatment of locally advanced cervical cancer: a comprehensive review: Int J Ginecological Cancer, 2022
G C van Rhoon, M Franckena, T L M Ten Hagen., A moderate thermal dose is sufficient for effective free and TSL based thermo-chemotherapy. Adv Drug Del, 2020
M. Dewhirst, JNCI Journal of the National Cancer Institute 2010 102(2):79-81
A. Sengedorj, et al. Interaction of Radiotherapy and Hyperthermia with the Immune System: a Brief Current Overview: Current Stem Cell Reports (2022)
Yohsuke Yagawa, Keishi Tanigawa, Yasunobu Kobayashi, Masakazu Yamamoto. Cancer Metastasis Treat 2017;3:218-30.
Dr. Hueseyin Sahinbas, Dr. Peter Holzhauer, Checkliste: Komplementaere Onkologie, Hippokrates 2010
N.Frazier et al., Hyperthermia Approaches for Enhanced Delivery of Naomedicines to Solid Tumors. Biotechnology and Bioengineerin, Vol 9999, No.xxx, 2015
Ahmed Bettaib et al., Hyperthermia: Cancer Treatment and Beyond, IntechOpen 2013
Baronzio G. F. and Hager, E.D., Hyperthermia in Cancer Treatment: A Primer, Introduction: Introduction and Brief Historical Notes on Hyperthermia. Springer 2006
Twombly R., International Study of Hyperthermia Spurs Hope in U. S. Advocates. JNCI NEWS 2010.
van der Zee J. et al., Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours: a prospective, randomised, multicentre Trial (THE LANCET 2000; 355: 1119-25)
Roesch M. and Mueller-Huebenthal B., Review: The Role of Hyperthermia in Treating Pancreatic Tumors. Indian J. of Surgical Oncology 2014
Acute exposure to high-induction electromagnetic field affects activity of model peripheral sensory neurons. - Published in: J Cell Mol Med 2018; 22 (2):1355-1362
I MECCANISMI D’INTERAZIONE DEL CAMPO ELETTROMAGNETICO CON I TESSUTI BIOLOGICI: 전자기장과 생물학적 조직의 상호 작용 메커니즘, Paolo Palangio, Angelo Lozito, Antonio Meloni, Cesidio Bianchi Istituto Nazionale di Geofisica e Vulcanologia – Via di Vigna Murata, 605 – 00143 Roma, 2008
'온열치료' 카테고리의 다른 글
| [온열치료 전문가 칼럼 33] 시판 중인 국소 부위 고주파 온열 암 치료기별 특성 비교 (1) | 2024.12.26 |
|---|---|
| [온열치료 전문가 칼럼32] 국소 부위 고주파 온열 암 치료와 전신 온열치료의 조합 (3) | 2024.12.16 |
| [온열치료 전문가 칼럼30] 2024독일온열종양학회(DGHT) 현장 리뷰 6부(마지막) (2) | 2024.12.03 |
| [온열치료 전문가 칼럼29] 2024독일온열종양학회(DGHT) 현장 리뷰 5부 (0) | 2024.11.26 |
| [온열치료 전문가 칼럼28] 2024독일온열종양학회(DGHT) 현장 리뷰 4부 (2) | 2024.11.21 |




댓글